Галогенирование
Галогенирование
- Осуществление монобромирования с применением защиты ацильного типа
- Галоидирование третичных ароматических аминов
- Применение галогенирующих агентов
Галогенирование относится к категории важных и нередко производимых процессов для получения органических соединений.
Большая часть галогенопроизводные ароматического ряда используются при изготовлении различных веществ с необходимыми на практике характеристиками, включая красителей и средства противодействия вредоносной растительности, а также насекомым.
Галоидирование аренаминов с учетом характера галогена (фтор F, хлор Cl, бром Br, иод I, астат At, теннессин TS), а также условий реакции осуществляется с выходом тригалогенаренаминов. При воздействии на аминобензол водным раствором брома осуществляется реакция и образовывается триброманилин.
Течение реакции галоидирования доказывает существенное активизирующее воздействие аминогруппы на явления электрофильной замены. При хлорировании возможно осуществится реакция окисления аминогруппы. Для предупреждения окисления аренаминов, необходимо осуществить их защиту ацилированием по аминогруппе.
В то же время, в итоге присутствия объемной ацетамидной группы хлорирование в о-положении не осуществляется. Как правило, осуществляется образование n-хлорацетанилида. После с него осуществляют снятие защиты аминогруппы. При потребности получения лишь n-изомер, изначально ацилируют аминогруппу, потом бромируют N-Фенилацетамид (C8H9NO).
При галоидировании аминов в растворе сильных кислот совместно с n-изомером выходит большое количество m-изомера. Поясняется это тем, что в данных условиях галоидирование осуществляется не лишь непосредственно амина, но и галогенируется его соль.
Галоидирование ароматических аминов, фенолов и их несложных эфирных составляющих достаточно простое, и при мягких условиях имеет возможность реализовываться без катализатора с возникновением продуктов полизамены. Алкены быстро реагируют с бромом даже при низких температурах с образованием продукта подсоединения.
HC2 = CH2 + Br2 → BrCH2CH2Br
Равно как с гидроксибензолом (C6H6O либо C6H5OH), если воздействовать на анилин водным раствором брома, реакция осуществляется при температурных показателях, которые соответствуют примерно +20°C, с получением белого осадка кристаллического вещества, с молекулярной формулой С6H4NBr3 2,4,6-триброманилина (качественная реакция на аналин):
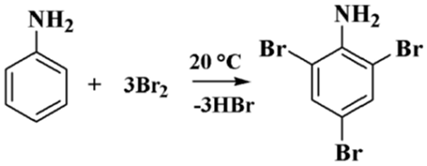
Рисунок 1.
Подобно брому с аминобензолом (C6H5NH2) осуществляет взаимодействие йод.
Производные анилина тоже сильно активизированы к замене электрофильными реактантами. Реакции, как правило, осуществляются при довольно мягких условиях. К примеру, по итогу галоидирования все свободные ортоположения и параположения стают замененными:
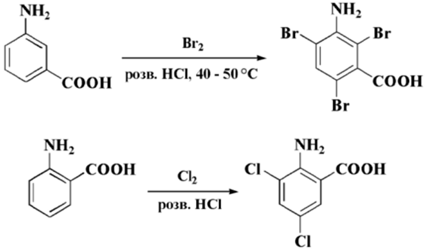
Рисунок 2.
Осуществление монобромирования с применением защиты ацильного типа
Для монобромирования дезактивированных производных анилина используют окислительное бромирование бромистым калием (KBr), а также надборнокислым натрием (NaBO3).
Возможность ароматических аминов реагировать с электрофильными реактантами уменьшается, если аминогруппу (—NH2) преобразовать в амидную группу (производные кислородсодержащих кислот). Единая электронная пара азота N, участвующая в осуществлении стабилизации положительного заряда, появляющегося в состоянии перехода при электрофильной замене, отныне получает частичное смещение к карбонильной группе (C=O) амида.
Амидные группы, как и ранее, считаются ортоориентантными, параориентантными, но в меньшей степени осуществляют активацию системы, как аминогруппа, таким образом, несложно осуществлять контроль электрофильных реакций производных амидов. Иной способ к восприятию облегчающего результата ацильной группы на азотный атом состоит в исследовании резонансных структур для промежуточных соединений, которые создаются ввиду электрофильной атаки, к примеру, по параположению к амидной группе:
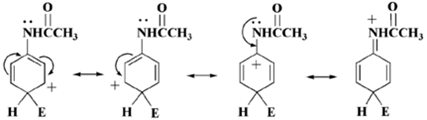
Рисунок 3.
Исходя из того, что появляющийся положительный заряд обладает возможностью нахождения в азоте, атака по данному положению (либо по oртоположению) доминирует сравнительно с метаположением. Но данная резонансная структура в меньшей степени является полезной, нежели переходное соединение, появляющееся в итоге атаки в параположения соответственного амина, поскольку положительно заряженный азотный атом находится возле положительно заряженного углеродного атома карбонильной группы. Сниженное активное состояние ацил-защищенной группы —NH2 применяют для осуществления моно-бромирования.
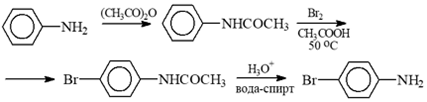
Рисунок 4.
Отличительным свойством считается четкое паpaориентирующее воздействие ацил-аминогруппы —NH2.
Для большей способности катализатора избирательно увеличивать скорость процесса галоидирования возможно использовать, к примеру, пиридин гидробромид пербромид и Py+HBr3- либо тетраалкиламмоний тригалогениды Alk4N+Br3-. Каталитическая активность тетраалкиламмоний галогенидов находится вне зависимости от природы катиона, но зависит от природы отрицательно заряженного иона – аниона.
Приемлемо активные субстраты-анилиды, арилгалогениды осуществляют бромирование легко, но для бромирования дезактивированных нитро-замененных и циано-замененных производных требуется избирательное ускорение кислотами Льюиса.
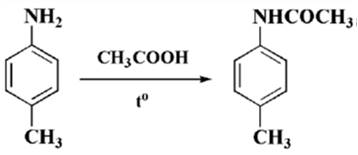
Рисунок 5.
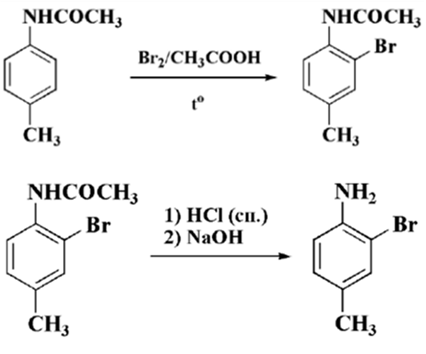
Рисунок 6.
Галоидирование третичных ароматических аминов
Соединения со свободной аминогруппой принадлежат к первичным аминам. Если один из водородных атомов одновалентной группы —NH2 заменяется алкиловой либо ариловой группой, данное получившееся соединение именуется вторичным амином, а осуществляя замещение двух водородных атомов, возникает третичный амин.
Реакции электрофильного ароматической замены удачно осуществляются с третичными ароматическими аминами. Диалкиламиногрупа считается достаточно мощным активирующим заменителем, и для проведения реакции используются довольно мягкие условия, даже если присутствуют дезактивирующие нитрогруппы —NO2, при этом избирательное ускорение кислотой Льюиса становится без надобности.
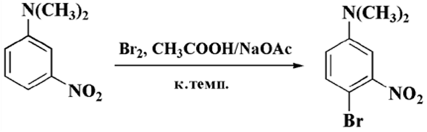
Рисунок 7.
Применение галогенирующих агентов
Галоидирование очень хорошо осуществляет активизацию при использовании меркурий ацетата либо трифторацетата. В данных условиях осуществляют генерирование гипогалогенитов, считающихся сильными галогенирующими реактантами. В особенности проявляет активность гипогалогенит трифторацетат. К примеру, гипобромит (HBrO) трифторацетатом возможно пробромировать даже нитробензен. Раствор брома в CCl4 с примесью сульфатной кислоты и оксида меркурия также считается активным галогенирующим реактантом.
(RCOO)2Hg + X2 ↔ (RCOO)Hg + RCOOX
R = CH3, CF3
N-бромосукцинимид (NBS), N-хлоросукцинимид (NCS) и N-йодосукцинимид (NIS) совсем недавно, в том числе, используются в роли активных галогенирующих электрофильных реактантов. Они имеют возможность осуществлять галоидирование сдержано активных ароматических соединений при наличии перхлорной кислоты HClO4 либо фторид бора (III) BF3 в водном растворе.
Можно сказать, что активность агентов галоидирования увеличивается в следующем порядке: молекулярный галоген; молекулярный галоген в присутствии катализатора кислоты Льюиса; положительно заряженный галоген.
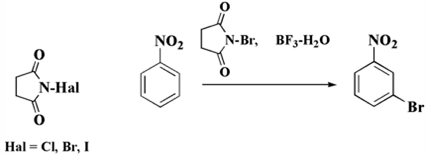
Рисунок 8.
